|

众所周知,肠道微生态的组成十分复杂,它对个体的生长发育、营养物质代谢、疾病等方面都有重要的作用,很多研究表明肠道微生物与癌症、肥胖、免疫疾病等相关。今天,小编将与大家分享一篇今年10月发表在Cell上的文章,题目是“Host-Protozoan Interactions Protect from Mucosal Infections through Activation of the Inflammasome”,即“原生生物与宿主之间的相互作用,能激活炎症小体从而使得宿主免受感染”。接下来我们就一起来看看这篇有趣的文章吧!
SUMMARY:
脊椎动物体内的原生生物对宿主的影响及其对粘膜免疫内环境稳态的作用仍然不清楚。本文展示了一种新发现的原生动物---小鼠三毛滴虫(T.musculis/T.mu),这种原生动物能激活宿主上皮细胞的炎症体并诱导IL-18释放。上皮细胞所分泌的IL-18能诱导树突状细胞,驱动Th1及Th17相关的免疫反应,从而保护宿主肠道粘膜免受感染。尽管T.musculis起到类似原生动物的作用,但作者发现它的定植会加剧T细胞相关的结肠炎以及散发的结直肠。作者展示了一种新的宿主与原生生物相互作用,这种作用能增强粘膜的宿主防御能力,但同时要承担更高的炎症性疾病的风险。
INTRODUCTION:
哺乳动物肠道中有许多微生物群体,包括病毒、原核微生物、真核微生物等。其中真核微生物包括无数的真菌、蠕虫、原生生物。研究表明一些原生生物是鼠及人类肠道的病原体,包括微孢子目,溶组织内阿米巴属,弓形虫,贾第鞭毛虫,及隐孢子虫,这些单细胞寄生生物的定植所引起的宿主免疫反应在人体和实验动物上已有深入的研究。相比之下,不断有证据表明,原生生物群落定居于哺乳动物肠道内,成为脊椎动物微生物组学的一部分。其中较为普遍和经典的原生生物有不等鞭毛类、变形虫、副基类等,它们在体内是共生或是致病仍旧神秘而充满争议。这类物种在对机体的免疫系统的作用一直被忽略。因此作者描述了此前未被发现的一类与啮齿类动物共生的原生动物---小鼠三毛滴虫(T.musculis),它能使上皮细胞的炎症体激活,刺激IL-18释放,从而抵抗对宿主粘膜的感染。但在动物模型中发现此种反应会对结肠炎及结直肠转归产生不利影响。
RESULTS:
小鼠肠道原生动物共生的鉴定

Figure1.A,B:来自西奈山动物中心的研究人员在例行分析C57BL/6小鼠肠道组织时,发现本中心饲养的小鼠比外部购买的小鼠的肠道中有更多的CD45+细胞。将Jackson实验室购买的小鼠及西奈山动物中心饲养的小鼠的结肠粘膜固有层细胞进行流式细胞术分析,发现西奈山动物中心的小鼠粘膜固有层中CD45+细胞显著高于外部购买的小鼠(Figure1A)。CD45.2+细胞计数也得出同样结果,p<0.001(Figure1B)。
Figure1.C:左图为Jackson实验室及西奈山实验动物中心小鼠血清中IgA浓度,右图为Jackson实验室及西奈山实验动物中心小鼠结肠组织标本中的IgA浓度,作者发现西奈山实验动物中心的小鼠血清及结肠组织标本的IgA均显著升高,而Jackson实验室的小鼠则不存在这种现象,p<0.001。
Figure1.D:对肠腔进行灌洗,用流式细胞技术分析,发现西奈山实验动物中心的小鼠肠腔内IgA阳性细胞(50%)明显多于Jackson实验室购买的小鼠(7%)。
Figure1.E,F:将D图中的IgA阳性细胞进行细胞离心涂片,吉萨姆染色,并用显微镜观察(40X),发现了一种类似于副基类原生生物的单细胞,有鞭毛的微生物。扫描电镜显示,这种微生物紧紧贴附于肠道上皮细胞表面。
Figure1.H:研究人员对这个新发现的微生物很感兴趣,于是将其DNA提取出来,进行了ITS PCR-DNA测序,发现这是一种新的原生动物寄生虫,于是将他命名为小鼠三毛滴虫(T.mu)。进化分析显示T.mu是独立的存在的,且与毛滴虫科的分支有95%的亲缘关系。
Figure1.G:作者十分好奇,T.mu的存在是否与肠道组织这中的固有免疫细胞增多及IgA水平升高有关,于是作者将分离纯化的T.mu灌入外部购买的B6小鼠胃内。灌胃后不同时间对T.mu的定植进行分析,发现其定植是终身的且在被定植的小鼠后代中也存在。更重要的是,作者发现灌胃形成的T.mu定植小鼠每克盲肠组织中含有的原生生物数量与自然定植小鼠之间无明显差异。
Figure1.I:作者发现尽管肠道组织造血明显扩增,但是却并没有找到T.mu定植小鼠粘膜损伤的组织学证据。图示与对照组相比,T.mu感染小鼠结肠及盲肠组织仅有轻度上皮细胞及杯状细胞增生。
Figure1.J:将对照组及T.mu感染组小鼠结肠及盲肠组织的染色片进行的病理学评分,如小图1、3所示两组之间无明显差异;对结肠及盲肠组织切片进行每高倍镜视野下杯状细胞计数,如小图2、4所示T.mu感染组小鼠杯状细胞数量显著高于对照组小鼠。
上述结果表明,排除事先存在的微生物群落的影响后,T.mu是成年小鼠肠道微生物群落的一部分,其定植对宿主无急性损伤。
T.mu定植后迅速在结肠组织内形成不同的免疫景观

我们先来看一个新技术,利于下文的理解。
CyTOF:质谱流式细胞技术是利用质谱原理对单细胞进行多参数检测的流式技术。它继承了传统流式细胞仪的高速分析的特点,又具有质谱检测的高分辨能力,是流式细胞技术一个新的发展方向。质谱流式细胞技术可以实现对细胞群体进行精准的免疫分型,对细胞内信号传导网络进行全面的分析,分析细胞亚群之间的功能联系,以及对于大量样品的高通量多参数检测。
为了探究T.mu是否与肠道组织固有免疫细胞的增殖相关,作者利用流式细胞技术及质谱流式细胞技术对T.mu定植后不同时间的结肠固有层细胞进行分析。
Figure2.A:用2×10^6高纯度的T.mu灌入B6小鼠胃中,对照组用等量PBS灌胃处理,8周后,取结肠粘膜固有层细胞,用抗CD45.2抗体染色后进行流式细胞分析。如图所示,T.mu处理组小鼠CD45阳性细胞比例明显高于对照组。
Figure2.B:显示了对照组小鼠及T.mu定植组小鼠结肠粘膜固有层细胞中CD45阳性细胞的绝对值。如图所示T.mu处理组小鼠CD45阳性细胞数明显高于对照组,p<0.001。
Figure2.C:作者用质谱流式细胞分析了高纯度T.mu处理后一周,小鼠结肠组织内髓系免疫细胞组成。通过对照组及T.mu处理组对比可见T.mu定植后结肠组织内免疫细胞构成的改变。如图所示,单核细胞增多,巨噬细胞增多,CD103–CD11b+树突状细胞增多,中性粒细胞增多。
Figure2.D,E:通过流式细胞分析及细胞计数,作者发现髓系免疫细胞组成的改变与巨噬细胞产生TNF-a增多及Ly6Chi 单核细胞浸润增强有关。
Figure2.F,I:我们知道IL-17和 IFNɤ由CD4+Th细胞(Th1)产生,而 IL-5 和IL-13由Th2细胞产生。作者同时发现,T.mu定植2周后,IL-17和 IFNɤ标记阳性的细胞较对照组明显升高,而IL-5 和IL-13标记阳性的细胞却与对照组无明显差异。
Figure2.J:CD4+IFNɤ+Th1细胞在定植后2月出现峰值并趋向水平,而CD4+IL-17+Th17细胞在定植后2-3周升高,且峰值较前者低。
以上数据显示,T.mu定植动物中,T.mu是驱动免疫调节的主要因素。因此作者就思考究竟是什么在推动着小鼠体内的T.mu诱发Th1细胞和Th1细胞的免疫反应?
结肠组织中不同树突状细胞各有分工帮助定植后的T.mu形成粘膜免疫

Figure3.A:CCR7是一种细胞因子受体,能控制树突状细胞DC从粘膜迁移至肠系膜引流淋巴结,Ccr7-/-小鼠的肠系膜引流淋巴结中缺乏迁移的DCs。如图所示,对照组及Ccr7-/-组小鼠分别经纯化T.mu灌胃,14天后,对小鼠结肠粘膜固有层细胞进行分析,T.mu定植并没有使得Ccr7-/-组小鼠出现Th1及Th17细胞增殖,这说明在活体中,T.mu定植引起效应性T细胞的反应,必须存在DCs迁移才能发生。
粘膜固有层的DCs包含许多不同的亚型,其中CD103+CD11b+F4/80–Flt3+ DCs需要转录因子干扰素调节因子4(IRF4)参与其分化,这类DCs主要驱动粘膜组织的Th2及Th17分化。CD103+CD11b-F4/80–Flt3+ DCs需要转录因子干扰素调节因子8(IRF8)参与其分化,这类DCs主要驱动粘膜组织的CD8+T细胞免疫。为了更直接地证明T.mu定植小鼠中,各类型的DCs是如何诱导效应T细胞增殖,作者使用了DC特异性敲除的,这些缺乏特定的DC亚型。
Figure3.B,C,D:Batf3-/-小鼠粘膜固有层细胞缺乏CD103+CD11b– DCs但拥有CD103+CD11b+ DCs,因此它无法引起T.mu定植小鼠结肠粘膜固有层的CD4+IFNγ+ Th1细胞增殖,但能使CD4+IL-17+ Th17细胞增殖。
Figure3.E,F:由于IRF8基因在CD103+DC分化中起到重要作用,IRF8基因缺失小鼠同样不能诱发T.mu特异性Th1细胞反应。作者将Cd11cCre小鼠与Irf8flox/flox小鼠,得到Irf8△DC小鼠,这种小鼠缺乏CD103+CD11b– DCs且无法诱导CD4+IFNγ+ Th1细胞增殖,但其诱导的CD4+IL-17+ Th17细胞增殖与Irf8flox/flox小鼠诱导的CD4+IL-17+ Th17细胞增殖无明显差异。
Figure3.G,H:为了证明CD103+CD11b+F4/80–Flt3+ DCs在T.mu定植后诱导产生免疫反应的的作用,作者将Cd11cCre小鼠与Irf4flox/flox小鼠,得到缺乏CD103+CD11b+ DCs的Irf4△DC小鼠。在T.mu定植2周后,Irf4flox/flox小鼠与Irf4△DC小鼠结肠粘膜固有层的CD4+IFNγ+ Th1细胞增殖之间无明显差异,而Irf4△DC小鼠结肠粘膜固有层的CD4+IL-17+ Th17细胞增殖明显少于Irf4flox/flox小鼠。
以上结果表明,T.mu定植个体中,CD103+CD11b– DCs与CD103+CD11b+ DCs在诱导Th1,Th17免疫的过程中起着不同的作用。
T.mu通过激活ASC及IL-18从而形成结肠的适应性免疫

Figure4.A:IL-12和IL-18与Th1细胞免疫的诱导相关。作者发现T.mu定植的结肠粘膜中IL-18释放水平较对照组升高,p<0.001。
Figure4.B:于是作者就试图去证明IL-18产生增多是否参与诱导T.mu定植小鼠的Th1细胞免疫反应。作者发现T.mu定植在IL-18-/-小鼠体内后,CD4+IFNγ+ Th1及CD4+IL-17+ Th17的增殖被阻断。
Figure4.C:前体IL-18在caspase-1的激活下形成成熟且有活性的IL-18。Caspase-1的激活由一种称为“炎症小体”的胞浆多蛋白复合物所驱动,在多数情况下还需要连接蛋白---凋亡相关点状蛋白(ASC)参与。IL-18可由许多不同的细胞产生,包括肠道上皮细胞,基质细胞及造血细胞。作者想知道在T.mu感染后,究竟是上皮细胞还是造血细胞诱导IL-18产生。这里介绍一下骨髓嵌合体小鼠:仅指骨髓系统细胞为异性状的嵌合体小鼠,为与免疫、造血系统有关的实验所使用。从 A系统的小鼠中采取骨髓细胞,在除去混存 T淋巴细胞后,用致死量的放射线(约 100 R)照射的 B系统或( A× B) F1 移于小鼠(通过静脉注射),此时移入骨髓细胞中的造血在受体内增殖分化,生成所有种类的血细胞(包括淋巴细胞)。结果是受体内的血球所有 A系统的全被代换。由于这些细胞的作用,受体可免除放射线致死。作者将野生型小鼠用致死量的射线照射,并分别移植IL-18+/+ 及IL-18-/-骨髓细胞,形成两种类型小鼠即IL-18+/+BM 及IL-18-/-BM。IL-18-/-BM小鼠粘膜造血区室内缺乏IL-18。8周以后,实验组用T.mu处理,对照组做相应对照处理,作者发现与对照组相比,IL-18+/+BM 及IL-18-/-BM小鼠在T.mu定植后的免疫反应无明显差异,这表明T.mu驱动的结肠Th1,Th17免疫反应是由结肠上皮细胞产生的IL-18所控制的。
Figure4.D:为了进一步探索IL-18在T.mu感染的宿主免疫反应中的作用,作者用T.mu感染了Asc-/-小鼠,这种小鼠无法产生有活性的caspase-1和具有生物活性的IL-18。同样,作者发现Asc-/-小鼠在T.mu感染后并不能在结肠组织引起Th1,Th17反应性升高。这进一步证明了炎症小体在T.mu相关的适应性免疫反应中的重要作用。
Figure4.E:ASC驱动caspase-1的活化能同时使IL-1β前体分离。然而,作者用T.mu感染IL-1r-/-小鼠后发现,IL-1r基因缺失对小鼠结肠粘膜诱导CD4+IFNγ+ Th1及CD4+IL-17+ Th17免疫反应较小。
T.mu定植后通过激活炎症小体从而保护粘膜免受感染
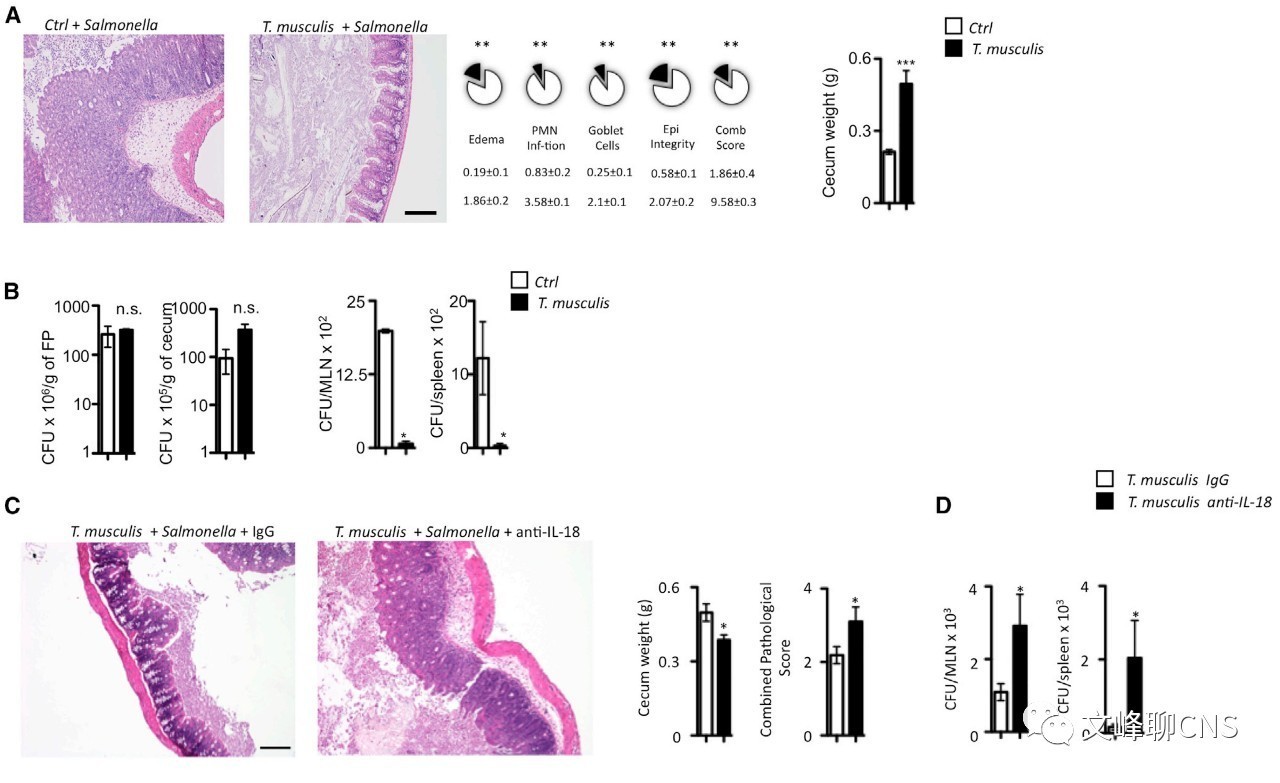
前面的研究表明:T.mu定植后,小鼠大肠及盲肠产生的强烈的Th1细胞增殖反应,于是作者就想知道T.mu在宿主粘膜防御机制中的潜在作用。因此,作者进一步深入研究,T.mu定植对沙门菌引起的小肠结肠炎的结局是否有影响。
Figure5.A:T.mu定植14天后,分别使对照组和T.mu定植组感染沙门菌。作者惊奇地发现,对照组在沙门菌感染后,盲肠炎症十分严重,而T.mu定植组在沙门菌感染后盲肠切片HE染色几乎没有发现炎症改变。在感染沙门菌之前,所有病理性参数包括结肠多核粒细胞浸润、粘膜水肿、杯状细胞减少、以及上皮细胞整合在T.mu定植组中均明显于对照组。
Figure5.B:如图所示,对照组和T.mu定植组小鼠的粪粒、盲肠中沙门菌菌落形成单位(CFU)均无明显差异,表明两组的沙门菌感染程度相近。同时作者发现T.mu定植组小鼠的肠系膜引流淋巴结、脾脏中的沙门菌菌落形成单位(CFU)较对照组明显减少。
Figure5.C,D:上述结果表明结肠上皮细胞释放的IL-18在T.mu诱导的免疫中有重要作用。于是作者便提出一个问题, IL-18是否参与T.mu介导的沙门菌感染的粘膜保护作用。于是作者再次设计了实验。将沙门菌感染的T.mu定植小鼠分为两组,分别连续三天注射200ugd IgG或中和性抗IL-18抗体。作者发现与IgG组相比,注射中和性抗IL-18抗体显著削弱了T.mu介导的沙门菌感染的粘膜保护作用,并加重了沙门菌感染。
以上数据表明,在含有T.mu的微生物群中,T.mu通过诱导炎症小体驱动的结肠上皮细胞IL-18释放,从而显著增强粘膜抗感染能力。
T.mu定植增加了致病性炎症的易感性

结肠组织中持续存在的高水平的炎症分子引发作者的思考,T.mu是否会有助于定植小鼠的致病性炎症。因此作者将普通小鼠及GF小鼠的免疫缺陷重组激活基因2(Rag-/-)敲除小鼠用T.mu处理,2周后注射高纯度的CD4+CD45RBhi效应T细胞。将效应T细胞注射入Rag-/-小鼠体内会使其出现肠道炎症并引起持续性体重下降,而GF小鼠则不会出现此类症状。
Figure6.A: 结果表明,事先感染T.mu的普通小鼠及GF小鼠在T细胞转入后比未感染小鼠病情更加严重,从开始到T细胞转入后2
|


